Enfermería: Cuidados Humanizados, 13(2)
julio-diciembre 2024
10.22235/ech.v13i2.4223
Artículos originales
Errores preanalíticos en laboratorios clínicos: revisión integrativa
Pre-analytical Errors in Clinical Laboratories: An Integrative Review
Erros pré-analíticos em laboratórios clínicos: revisão integrativa
Ignacio Azocar González1 ORCID 0009-0001-7993-7108
María Loreto González-González2 ORCID 0009-0001-5628-0502
Francisca Sepúlveda Maturana3 ORCID 0009-0004-7184-5331
Claudia Azocar González4 ORCID 0009-0003-6305-9050
Mirliana Ramírez-Pereira5 ORCID 0000-0003-1439-4162
1 Universidad Diego Portales, Chile
2 Hospital Claudio Vicuña, Chile
3 Universidad Diego Portales, Chile
4 Investigadora independiente, Chile
5 Universidad de Chile, Chile, [email protected]
Resumen:
Introducción: Un adecuado manejo de la fase
preanalítica es crucial para los profesionales de enfermería porque garantiza
la precisión y confiabilidad de los resultados de laboratorio, fundamentales
para diagnósticos y tratamientos efectivos.
Objetivo: Identificar en la literatura disponible los errores
preanalíticos en laboratorios clínicos.
Metodología: Revisión integrativa a través de las bases de datos PubMed,
Scopus y Scielo. Se utilizaron los criterios PRISMA para seleccionar y evaluar
estudios relevantes publicados entre 2019 y 2024. Los estudios seleccionados
fueron evaluados críticamente y sintetizados utilizando el método de
comparación constante: reducción de datos, visualización de datos, comparación
de datos, elaboración de conclusiones.
Resultados: Los artículos identificados inicialmente fueron 80 (PubMed =
66, Scopus = 14, Scielo = 0) y se incluyeron 34 estudios que cumplieron los
criterios de selección para esta revisión. Se identifica que los errores
preanalíticos son predominantes, representando un alto porcentaje de errores en
el laboratorio, siendo la mala preparación y manejo de muestras las causas más
comunes. Estos errores aumentan los costos y comprometen la calidad
diagnóstica.
Conclusión: La estandarización de procedimientos y la capacitación del
personal son esenciales para reducir estos errores y mejorar la seguridad del
paciente.
Palabras clave: análisis químico de la sangre; calidad de la atención de salud; fase preanalítica; prueba de laboratorio.
Abstract:
Introduction: Adequate management of the
preanalytical phase is crucial for nursing professionals because it guarantees
the accuracy and reliability of laboratory results, which are essential for
effective diagnosis and treatment.
Objective: To identify preanalytical errors in clinical laboratories in
the available literature.
Methodology: Integrative review through PubMed, Scopus and Scielo
databases. PRISMA criteria were used to select and evaluate relevant studies
published between 2019 and 2024. Selected studies were critically appraised and
synthesized using the constant comparison method: data reduction, data
visualization, data comparison, drawing conclusions.
Results: The initially identified articles were 80 (PubMed = 66, Scopus
= 14, Scielo = 0) and 34 studies that met the selection criteria for this
review were included. Pre-analytical errors are identified as predominant,
representing a high percentage of errors in the laboratory, with poor sample
preparation and handling being the most common causes. These errors increase
costs and compromise diagnostic quality.
Conclusion: Standardization of procedures and staff training are
essential to reduce these errors and improve patient safety.
Keywords: blood chemical analysis; quality of health care; pre-analytical phase; laboratory test.
Resumo:
Introdução: Um manejo adequado da fase
pré-analítica é crucial para os profissionais de enfermagem, pois garante a
precisão e a confiabilidade dos resultados laboratoriais, fundamentais para
diagnósticos e tratamentos eficazes.
Objetivo: Identificar na literatura disponível os erros pré-analíticos
em laboratórios clínicos.
Metodologia: Foi realizada uma revisão integrativa por meio das bases de
dados PubMed, Scopus e Scielo. Foram utilizados os critérios PRISMA para
selecionar e avaliar estudos relevantes publicados entre 2019 e 2024. Os
estudos selecionados foram avaliados criticamente e sintetizados utilizando o
método de comparação constante: redução de dados, visualização de dados,
comparação de dados e elaboração de conclusões.
Resultados: Foram inicialmente identificados 80 artigos (PubMed = 66,
Scopus = 14, Scielo = 0), dos quais 34 estudos cumpriram os critérios de
seleção para esta revisão. Identificou-se que os erros pré-analíticos são
predominantes, representando uma alta porcentagem de erros laboratoriais, sendo
a má preparação e o manejo inadequado de amostras as causas mais comuns. Esses
erros aumentam os custos e comprometem a qualidade diagnóstica.
Conclusão: A padronização de procedimentos e a capacitação da equipe são
essenciais para reduzir esses erros e melhorar a segurança do paciente.
Palavras-chave: análise química do sangue; qualidade da atenção à saúde; fase pré-analítica; testes laboratoriais.
Recibido: 21/08/2024
Aceptado: 24/10/2024
Introducción
La práctica basada en la evidencia es el instrumento de calidad que da soporte a la práctica clínica. Por ello, es necesario investigar y revisar literatura que permita actualizar conceptos e identificar estrategias que mejoren la calidad del cuidado del paciente. (1)
Este aspecto se vincula directamente con el rol asistencial de enfermería, en cual es fundamental un proceso lógico y estandarizado de la toma de muestras sanguíneas en diferentes contextos de atención de salud. (2)
La medicina del laboratorio se define como una ciencia que genera información clínica analizando la concentración, composición y/o estructura de variados analitos en fluidos biológicos, los que gracias a los avances tecnológicos y de gestión, han entregado un aporte fundamental al cuidado de la salud con una importante contribución en la medicina clínica, vigilancia epidemiológica e investigaciones científicas. (3)
El proceso analítico total de pruebas de laboratorio fue definido hace 50 años por George Lundberg como el ciclo “cerebro a cerebro”, y se ha dividido en tres fases: preanalítica, analítica y postanalítica. (4)
La norma ISO 15189:2012 definió la fase preanalítica como los pasos que consideran la solicitud de parte del personal sanitario, la preparación del paciente, recolección de la muestra, transporte hacia y dentro del laboratorio, esta fase finaliza con el inicio del proceso de análisis. (5)
La Organización Internacional de Normalización (ISO), bajo el estándar ISO 15189:2012, incluyó la definición de umbrales y criterios de mejora en la gestión de la calidad preanalítica. (5) En su actualización, ISO 15189:2022 estableció como requisito para la acreditación la necesidad de que los laboratorios clínicos implementen estos indicadores para monitorear y evaluar sus desempeños, con el fin de garantizar un servicio de salud confiable. (6)
La Organización Mundial de la Salud (OMS) define la seguridad del paciente como “la reducción del riesgo de daños innecesarios relacionados con la atención sanitaria hasta un mínimo aceptable”. (7) La Organización Internacional de Normalización (ISO) define el error de laboratorio como una operación fallida durante las fases preanalítica, analítica y postanalítica del trabajo del laboratorio, que fue planificada pero no se cumple o se realiza incorrectamente. (8)
Por otro lado, es relevante mencionar que los indicadores de calidad, estrechamente relacionados con la seguridad del paciente, son herramientas objetivas que proporcionan evidencia sólida de la calidad en todas las etapas del proceso de análisis, garantizando la seguridad del paciente al reducir las tasas de error y asegurando que los resultados entregados sean confiables y verídicos. (9)
Un error preanalítico ocurre cuando no se cumplen con los criterios de aceptabilidad del laboratorio, como por ejemplo cuando no se realiza o no se proporcionan los resultados de una prueba analítica, lo que puede llevar al rechazo de la muestra al no tener la capacidad de generar resultados fidedignos en los exámenes solicitados. (10)
Por otro lado, la literatura describe que errores en el laboratorio son comunes y transversales, afectando la seguridad del paciente, causando estrés y ansiedad innecesarios. También contribuyen a diagnósticos erróneos o tardíos, costos injustificados para el paciente y la red de salud, terapias inadecuadas, repetición de muestras, investigaciones de seguimientos innecesarias, además de afectar la efectividad clínica, generar insatisfacción en el paciente y desacreditar el laboratorio clínico. (11)
El problema de investigación planteado fue: ¿Cuál es la evidencia disponible sobre los errores que se presentan en la fase preanalítica en los exámenes de laboratorio clínico? El objetivo fue identificar en la literatura disponible los errores preanalíticos en los laboratorios clínicos.
Material y método
Se realizó una revisión integrativa con el fin de recopilar y sintetizar información que permitiera obtener una comprensión amplia y profunda de este fenómeno. (12, 13) Con el fin de asegurar la calidad y transparencia del presente reporte se usaron los criterios incluidos en Preferred Reporting Items for Systematic reviews and Meta-Analyses (PRISMA). (14)
El enfoque metodológico que guía esta revisión integrativa sigue los lineamientos propuestos por Broome (2019), quien enfatiza la importancia de integrar diversos tipos de evidencia para desarrollar conceptos robustos en el campo de la enfermería. Este método permite la inclusión de estudios con diseños heterogéneos y favorece una comprensión más amplia y profunda de fenómenos complejos, como los errores preanalíticos en los laboratorios clínicos. (15)
En primer lugar, se formuló la pregunta de investigación: ¿Cuál es la evidencia disponible sobre los errores que se presentan en la fase preanalítica en los exámenes de laboratorio clínico? Se establecieron criterios de inclusión rigurosos para seleccionar los estudios relevantes. Los artículos debían estar relacionados con el tema, publicados en inglés, español o portugués, disponibles en texto completo, de acceso libre y revisados por pares. Dentro de las limitaciones del estudio se encuentran:
- Criterio de inclusión restringido a artículos de acceso libre: esta decisión limita el acceso a publicaciones de revistas con alto factor de impacto que podrían ofrecer estudios más relevantes o con una mejor calidad metodológica.
- Limitación temporal de la búsqueda (2019-2024): aunque esta restricción temporal garantiza que solo se utilicen estudios recientes, también podría excluir investigaciones previas relevantes que hayan proporcionado datos fundamentales sobre los errores preanalíticos.
- Uso limitado de bases de datos: si bien se emplearon bases de datos importantes como PubMed o Scopus, la exclusión de otras fuentes clave podría haber restringido la búsqueda a una visión parcial de la literatura disponible. Además, no se encontraron artículos en Scielo, lo cual puede ser relevante para estudios en regiones específicas como América Latina.
- Potencial sesgo de publicación: al incluir solo estudios revisados por pares y de acceso libre, es posible que se excluyan estudios relevantes que no cumplan con estos criterios.
La búsqueda de la literatura se realizó en bases de datos reconocidas por su relevancia en el ámbito de la salud y las ciencias biomédicas. Estas bases de datos incluyeron Scielo, PubMed y Scopus. Además, se revisaron listas de referencias de artículos relevantes y se consultaron organizaciones especializadas en el tema.
Para asegurar una estrategia de búsqueda exhaustiva, se utilizaron términos específicos como “blood chemical analysis”, “quality of health care”, “pre-analytical phase” y “laboratory test”, aplicados en el título, resumen o texto completo de los artículos. Se documentaron las estrategias de búsqueda completas para cada base de datos, incluyendo los filtros y límites aplicados para restringir los resultados a estudios revisados por pares publicados en el periodo especificado. Se incluyó el booleano AND. La última búsqueda en cada una de estas fuentes se llevó a cabo en junio de 2024.
El proceso de selección de estudios implicó una revisión meticulosa para determinar si los artículos cumplían con los criterios de inclusión. Dos revisores evaluaron de manera independiente cada registro y cada informe recuperado. Se emplearon herramientas de automatización, como software de gestión bibliográfica, para la eliminación de duplicados y la selección inicial de estudios. En caso de discrepancias, se discutieron hasta llegar a un consenso. La evaluación de los datos por nivel de evidencia se realizó utilizando el enfoque GRADE. Este proceso incluyó la valoración de la calidad metodológica de cada estudio según criterios previamente establecidos, tales como el diseño del estudio, la consistencia de los resultados y la aplicabilidad clínica. (16)
La recolección de datos de los informes seleccionados fue realizada por dos revisores de manera independiente, siguiendo un protocolo estandarizado. Se incluyeron procesos para obtener o confirmar datos directamente de los investigadores de los estudios cuando fue necesario, y se utilizaron herramientas de automatización para facilitar esta tarea. Los datos fueron evaluados críticamente para asegurar su validez y relevancia. Se utilizó una herramienta estandarizada para la evaluación de la calidad de los estudios, y cada estudio fue evaluado por al menos dos revisores de manera independiente. El análisis de los datos incluyó la reducción, visualización, comparación y síntesis de los resultados. Los métodos utilizados para tabular y mostrar visualmente los resultados de los estudios individuales y las síntesis se describieron detalladamente. Para cada resultado, se especificaron las medidas del efecto utilizadas, como la razón de riesgo o la diferencia de medias.
Además, se evaluó el riesgo de sesgo en los estudios incluidos, describiendo las herramientas empleadas, el número de revisores y su independencia en el proceso. Se detallaron los métodos utilizados para evaluar la certeza o confianza en el cuerpo de evidencia para cada resultado.
Finalmente, los resultados se presentaron de manera estructurada, en cinco categorías: 1) Preparación del paciente, 2) Solicitud de examen, 3) Extracción de la muestra, 4) Almacenamiento y traslado de la muestra y 5) Error preanalítico, destacando las principales conclusiones y recomendaciones para la práctica clínica y futuras investigaciones. Se utilizó un diagrama de flujo PRISMA para documentar el proceso de selección de estudios, mostrando el número de estudios identificados, incluidos y excluidos, y las razones de exclusión.
Resultados
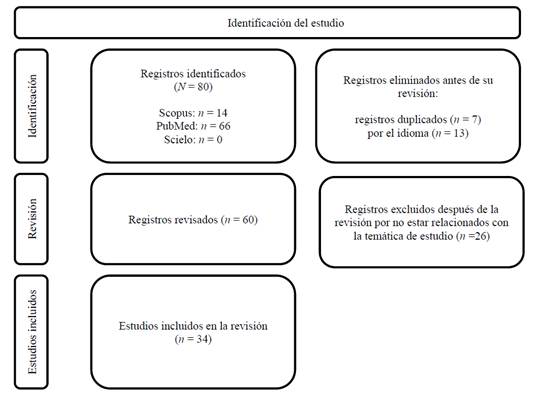
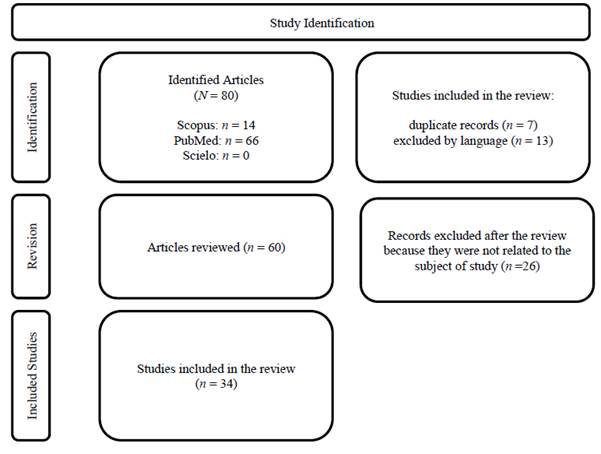
De la revisión de los artículos se identificaron inicialmente 80 registros en bases de datos, con 14 provenientes de Scopus y 66 de PubMed. En Scielo no se encontraron artículos con la temática en estudio. De estos registros, 20 fueron eliminados antes de la revisión: 7 por ser duplicados y 13 por el idioma. Posteriormente, se revisaron 60 registros, de los cuales 26 fueron excluidos por no estar relacionados con la temática del estudio. Finalmente, 34 estudios fueron incluidos en la revisión final (Figura 1).
Figura 1: Diagrama de flujo PRISMA: resumen del proceso de selección de estudios
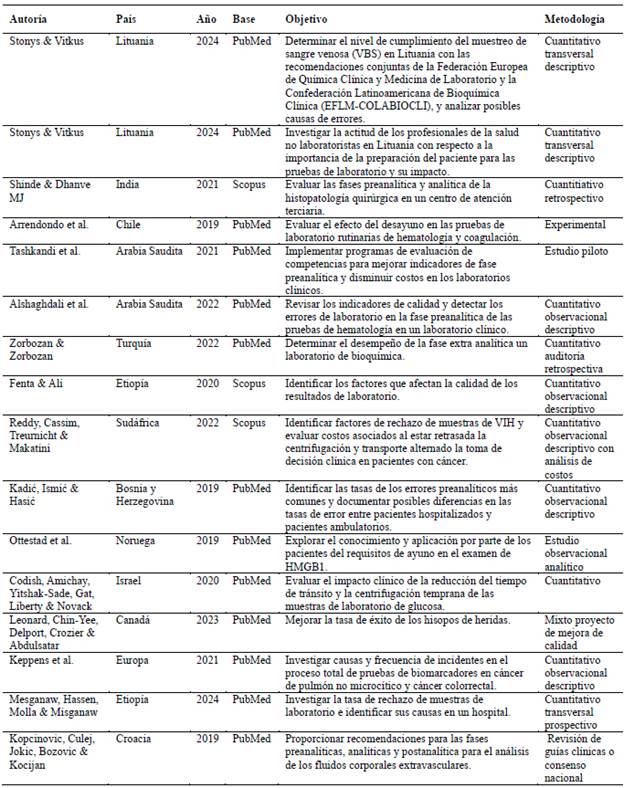
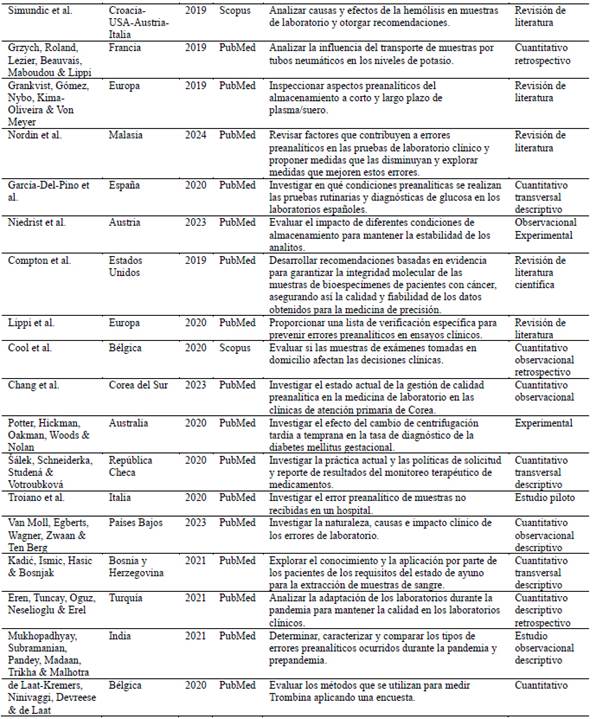
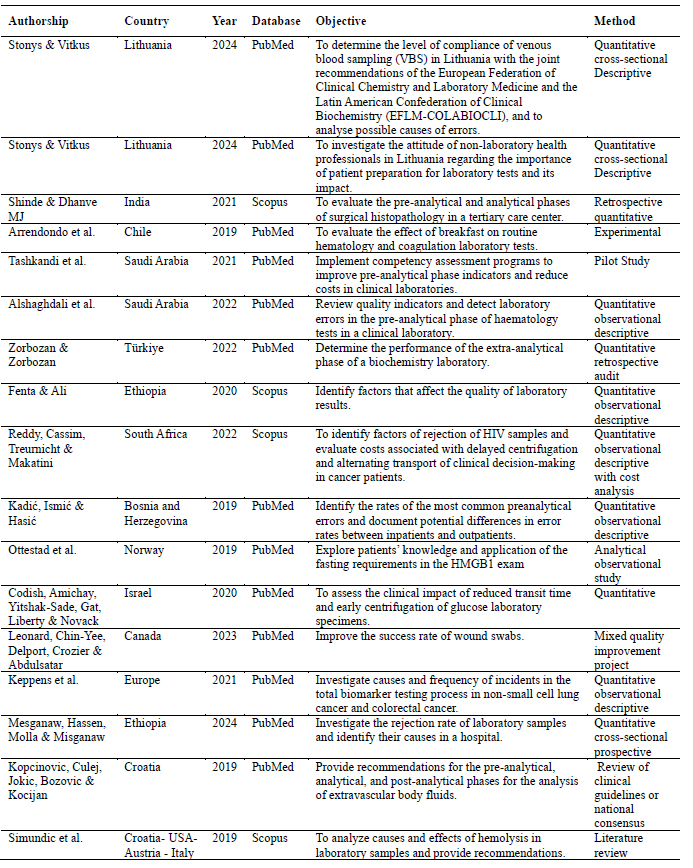
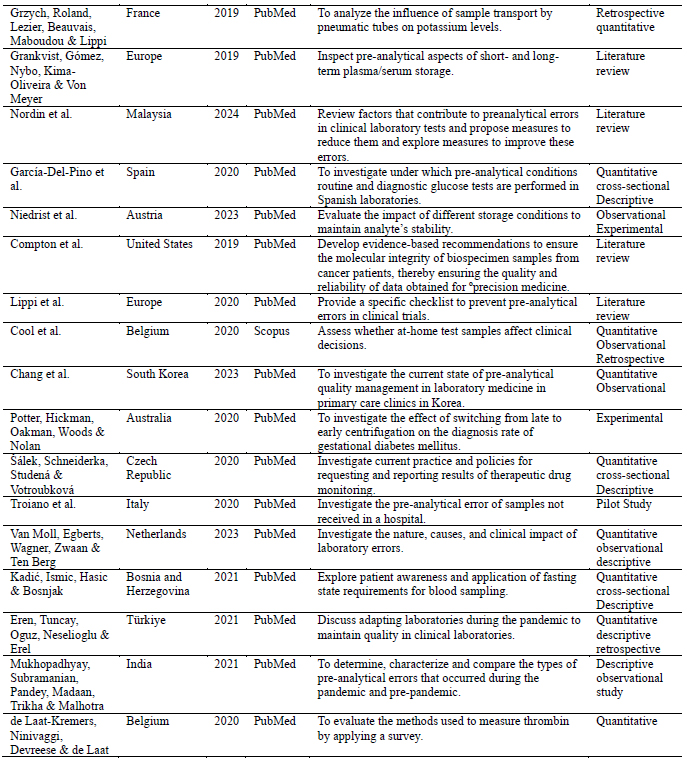
Con el propósito de organizar los datos para el análisis, se creó una tabla que incluye la información general de cada artículo (Tabla 1). En esta se detalla el objetivo de cada estudio, con el fin de llevar a cabo una categorización inductiva basada en los ejes temáticos en la fase siguiente.
Tabla 1: Características de los estudios seleccionados
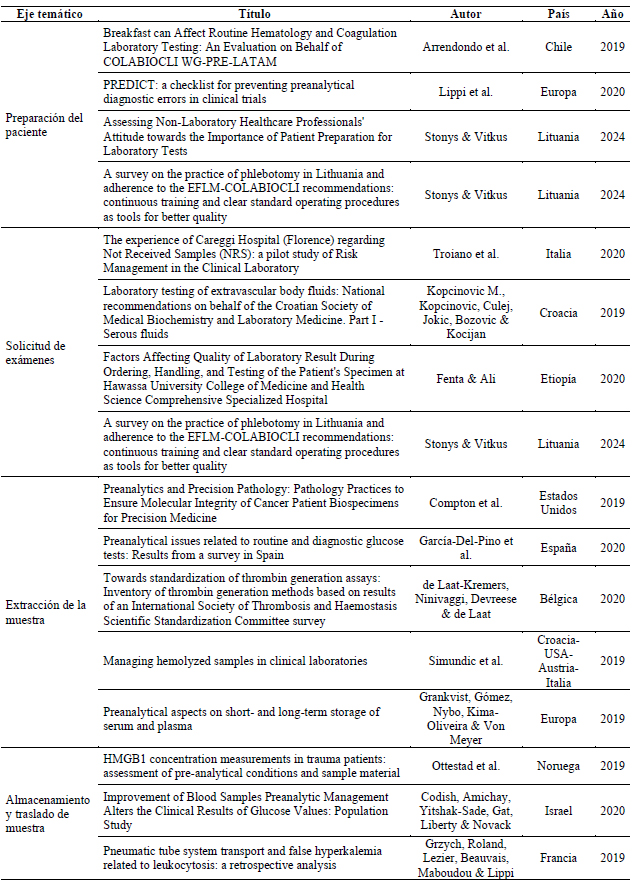
Luego del análisis de contenido se identificaron cinco ejes temáticos en los cuales se evidencian las características de la fase preanalítica. Las categorías que emergieron son las siguientes:
1. Preparación del paciente: Consiste en la entrega de los requisitos previos para la toma de exámenes, los cuales dependerán del analito a estudiar.
2. Solicitud de exámenes: Corresponde a la emisión de la solicitud del examen por el médico.
3. Extracción de muestra: En un procedimiento controlado y estandarizado que consiste en la recolección de sangre u otros fluidos corporales para análisis clínico, diagnostico o tratamiento. de una vena.
4. Almacenamiento y traslado de muestra: El almacenamiento de muestras implica condiciones adecuadas para preservar la estabilidad de las muestras recolectadas hasta la realización del análisis. El traslado de muestra es el transporte desde el lugar de recolección hasta el laboratorio para su análisis.
5. Error preanalítico: Esta categoría corresponde a la operación fallida durante la fase preanalítica del trabajo de laboratorio, que fue planificada pero no llega a cumplirse o se realiza incorrectamente. Esta situación puede llevar al rechazo de la muestra al no poder entregar uno o varios de los resultados solicitados.
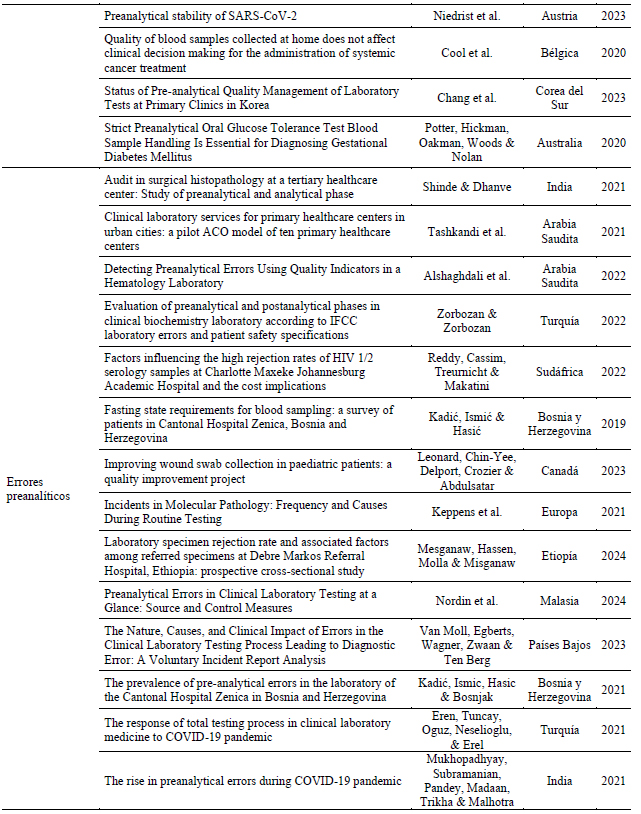
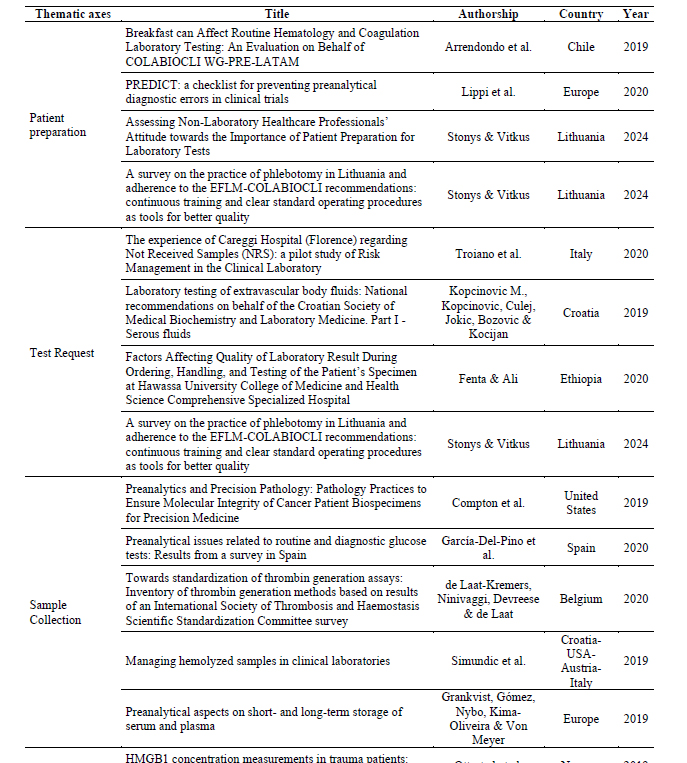
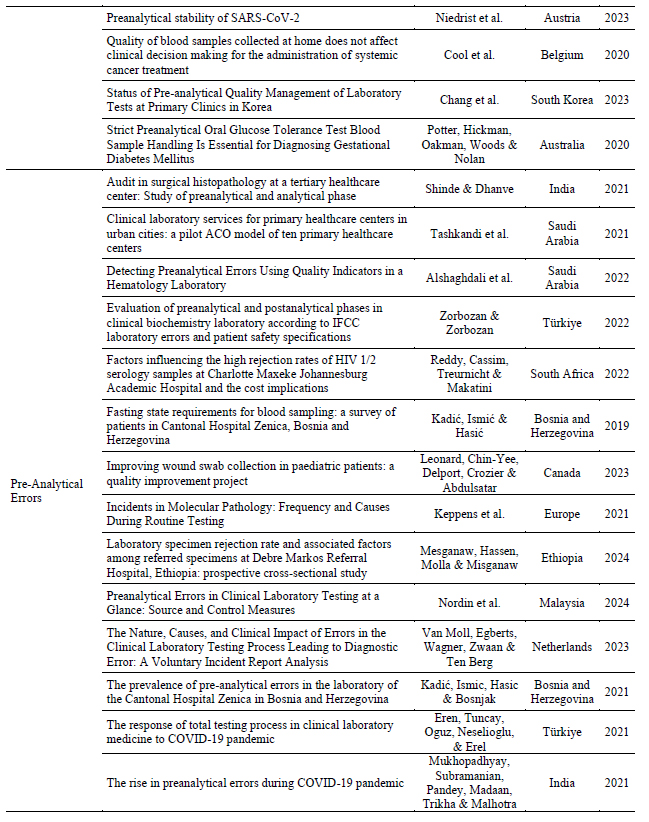
En la Tabla 2 se observan los artículos agrupados según categorías o ejes temáticos.
Tabla 2 – Ejes temáticos que emergen de los artículos seleccionados
Discusión
El manejo del examen de laboratorio es fundamental para un cuidado seguro y de calidad. Por esta razón, enfermeras y enfermeros deben conocer cuál es la evidencia que sustenta la praxis de la disciplina en esta área. A continuación, se presentan los ejes temáticos organizados en cinco categorías.
Eje temático 1: Preparación de paciente
Stonys y Vitkus mencionan que solo una minoría de los pacientes tiende a llegar bien preparados para la recolección de muestras de sangre, lo que es un problema en Lituania. Las causas de la falta de preparación adecuada incluyen la desinformación y la variabilidad en las recomendaciones proporcionadas por los laboratorios, lo que afecta la calidad de los resultados. (17) Arredondo evaluó la importancia del ayuno en las pruebas de hematología y coagulación. Se tomaron muestras en ayunas después del consumo de un desayuno estandarizado de carbohidratos, proteínas y lípidos, y posteriormente a la primera hora, segunda y cuarta postconsumo. Como resultados se comprobó que no hay recuperación a los valores basales en las siguientes 4 horas post ingesta de alimentos, por lo que consideran que, para los analitos incluidos en el estudio, el tiempo de ayuno debe ser considerado importante. (18)
Esto es corroborado por Lippi et al. quienes, en su publicación sobre la importancia de la fase preanalítica en estudios clínicos, otorgan especial relevancia a la preparación del paciente, de tal forma de que la muestra de sangre refleje efectivamente las condiciones reales del sujeto. Por ello, se indica que se debe recoger información precisa del uso de medicamentos y suplementos, así como las patologías que afectan al paciente, reforzando la importancia del tiempo de ayuno, la hora de la recolección de la muestra, la abstinencia del tabaco, no consumir café, así como evitar actividad física extenuante 48 horas y asegurarse de que el paciente esté sentado al menos 10 minutos antes de la extracción. (19)
Continuando con Lippi et al., también recomiendan, entre los pasos importantes, la confirmación de la identidad del paciente con al menos dos indicadores, definir el matriz de la muestra, especificar el volumen de muestra, aplicar el torniquete por menos de un minuto, definir el sitio de venopunción, realizar la venopunción por flebotomistas, seguir el orden de extracción recomendado y estandarizar la mezcla de muestras. (19)
Stonys y Vitkus, en su estudio sobre la actitud y la falta de comprensión de los profesionales de la salud no laboratoristas sobre la importancia de la preparación del paciente, aplicaron un cuestionario anónimo que reveló que estos profesionales consideran significativa la preparación del paciente en las pruebas de laboratorio, como el ayuno, el consumo de alcohol, tabaco o medicamentos, (enfermeras más que médicos). Sin embargo, la actitud frente al impacto de la actividad física, el día de ciclo menstrual y el ritmo circadiano mostró diferencias significativas según los años de experiencia laboral (más o menos de 20 años) y si han recibido capacitación al respecto. (20)
Eje temático 2: Solicitud de exámenes
Kopcinovic y col., en su estudio sobre el análisis de fluidos corporales, realizaron una recomendación a los profesionales involucrados en la recolección y procesamiento de estas muestras con el fin de estandarizar el procedimiento a nivel nacional. Para ello aplicaron una encuesta y revisaron evidencia a través de la literatura, reforzando la importancia del formulario de solicitud de prueba y orden de análisis, el cual debe contener: nombre y apellido del paciente, sexo, fecha de nacimiento, identificador único, fecha y hora de recolección, unidad hospitalaria, identificación del médico y sus datos de contacto, identificación de quien toma la muestra, procedimiento y sitio de recolección, y origen anatómico de la muestra. (21)
En un estudio realizado por Fenta y Ali para evaluar errores preanalíticos, observaron que el 87.5 % de las solicitudes de exámenes estaban incompletas en cuanto al diagnóstico clínico, 12.5 % no incluían el género y al 15 % les faltaba la edad. (22) De acuerdo con Kadic et al., los errores en identificación del paciente se asociaron a mayor ocurrencia de errores de laboratorio. Además, el 85 % de las solicitudes no tenían la hora de recolección de la muestra. (23)
Un estudio realizado por Šálek y col., que consistió en una encuesta para investigar los formularios de solicitud y los informes de resultados en el servicio de monitorización terapéutica de medicamentos en laboratorios, encontró que solo el 12 % implementaba todos los elementos necesarios para un óptimo monitoreo terapéutico de medicamentos. Estos elementos incluían: edad, peso corporal, momento de la muestra, fecha de la primera administración, hora de la última dosis administrada, dosis, intervalo de dosificación, vía de administración, objetivo de la prueba y otros medicamentos coadministrados. (24)
Eje temático 3: Extracción de muestra
Compton y col., en el caso de tejidos para exámenes moleculares, estiman que el grosor de la muestra ideal es de hasta 5 mm debido a la velocidad de penetración de la formalina. Para muestras de sangre, se enfatiza en factores como el tipo de tubo de recolección (tubo EDTA o tubos especializados para estabilización celular), el nivel de llenado del tubo según la recomendación del fabricante, y orden de extracción de los tubos en una extracción múltiple, para evitar contaminación cruzada. El orden recomendado es: tubo sin aditivo, tubo de coagulación con citrato de sodio, tubo con activador de coágulo, tubo con activador de coágulo y separador de suero, tubo de heparina que anticoagulante de heparina sódica o heparina de litio, tubo EDTA y tubos con otros aditivos como citrato, dextrosa-acido; oxalato/fluoruro y agente anti-glucolítico. Además, se deben realizar un número adecuado de inversiones para la mezcla adecuada del analito con el aditivo del tubo. (25)
Por otro lado, García del Pino y col., en su estudio sobre condiciones preanalíticas en exámenes de glucosa, enviaron una encuesta a distintos laboratorios y observaron que las condiciones en las que se realizan las pruebas no son ideales. El mayor porcentaje de muestras fue realizado en tubos de suero, seguido por tubos de plasma con heparina de litio y tubos de plasma con inhibidor de glicolisis como fluoruro de sodio en menor escala (19 %). La importancia del tubo de suero seleccionado no cumple con las condiciones del criterio diagnóstico de glucosa en plasma en ayunas. (26)
De Laat-Kremers y col. observaron una diversidad significativa entre los laboratorios en la fase preanalítica para la medición de generación de trombina. Realizaron un estudio a través de un cuestionario a los laboratorios en distintas localizaciones del mundo para conocer estas diferencias. El 68 % de los laboratorios utiliza solo plasma pobre en plaquetas, el 4 % solo plasma rico en plaquetas, el 24 % combina ambos tipos, el 1 % sangre completa y el 3 % combina los tres tipos. El 40 % extrae sangre con aguja mariposa y el 39 % con aguja recta. El 73 % usa tubos de extracción de plástico y el 14 % de vidrio. El anticoagulante preferido es el citrato de trisodio (83 %) y el 71% descarta el primer tubo de sangre. (27)
Simundic y col. observaron que las causas más importantes en la hemólisis durante la flebotomía fueron el uso de equipo no adecuado, como jeringas en lugar de tubos evacuados, el diámetro de aguja que favorece el flujo turbulento, el traspaso de sangre desde la jeringa al tubo de recolección, y los tubos de sangre con menor cantidad de sangre que la recomendada. Se recomienda la flebotomía desde la fosa antecubital y la mezcla suave de los tubos. (28)
La importancia de documentar el tiempo de recolección lo enfatiza Grankvist y col. en su estudio, debido a que varios factores pueden influir en la integridad de biomarcadores en muestras de suero y plasma. En el laboratorio de bioquímica clínica, las muestras usualmente se mantienen en sus tubos de recolección hasta el análisis en espera del transporte hacia el laboratorio. Muchos analitos son estables durante varias horas sin necesidad de centrifugación; sin embargo, aquellos inestables requieren ser centrifugados y transportados refrigerados o, en algunos casos, congelados antes del análisis. Esto es importante a considerar en aquellos centros periféricos de toma de muestra, los cuales deben tener disponibles insumos para realizar estos procedimientos previos al transporte. La estabilidad del analito debe ser asegurada por el laboratorio. Los laboratorios que requieren almacenamientos a largo plazo deben redoblar sus esfuerzos para manejar las variaciones preanalíticas como el ayuno, instrucciones sobre medicamentos, restricciones de tiempo de recolección, volumen de muestra, tiempo máximo de centrifugación y congelación. (29)
Eje temático 4: Almacenamiento y traslado de muestra
Niedrist y col. evaluaron el impacto de las condiciones de tiempo y temperatura de almacenamiento de rutina en los anticuerpos anti-nucleocapside (NC) y encontraron que sus niveles después de aproximadamente 3 meses a menos de 70 ºC o durante 14 días a temperaturas entre 2-10 ºC no disminuyen de manera significativa estadísticamente. Sin embargo, en plazos mayores a 1.5 años de almacenamiento se observaron desviaciones relevantes, pudiendo aumentar las tasas de positividad en pacientes convalecientes de COVID-19. (30)
Codish y col. refieren que el tiempo prolongado entre extracción de sangre y la separación de la masa celular puede disminuir los niveles de glucosa, influyendo en los diagnósticos de hiperglicemia e hipoglicemias. A través de la evaluación de pruebas de glucosa en ayunas en una población adulta antes, después de una intervención educativa, del establecimiento de cinco centros de centrifugación en ubicaciones claves de la ciudad y cambios en la ruta de transportes. Las muestras se mantenían en contenedores refrigerantes aislados con poliestireno a 20 ºC por un máximo de 2 horas hasta a centrifugación, con la temperatura de traslado monitoreada con un sistema de seguimiento con código de barras. Posterior a la implementación de estos cambios, los resultados de glucosa con valores sobre 100 mg/dl aumentaron significativamente de 9.83 % a 25.91 %, y las hipoglicemias (menor a 50 mg/dl) disminuyeron. (31)
Otro estudio de variación de glicemia lo realizaron Potter y col. en mujeres embarazadas. En un protocolo de centrifugación tardía versus centrifugación temprana (dentro de los 10 minutos de tomada la muestra), se obtuvieron de glucosa más elevadas en la centrifugación temprana, demostrando variación en la tasa de diagnóstico de diabetes mellitus gestacional dependiendo del tiempo de centrifugación. (32)
Ottestad y col. realizaron un estudio para evaluar el manejo preanalítico del HMGB1 (mediador de la inflamación sistémica en la sepsis y el trauma) tomando muestras arteriales y venosas, con tiempos de centrifugación demorada de 15 minutos, 3, 6, 12 y 24 horas almacenadas a temperatura ambiente. Encontraron que las muestras fueron estables hasta las 6 horas y las muestras arteriales presentaban una concentración 40 % más bajas que las venosas. (33)
Un estudio de Grzych y col. también evaluaron este tipo de transporte, sugiriendo que los valores de potasio en plasma pueden ser influenciados, lo que podría llevar a diagnósticos erróneos. (34) Cool y col. exploraron si la calidad preanalítica se ve afectada en las tomas de muestras sanguíneas realizadas a domicilio del paciente con cáncer en tratamiento, debido a la centrifugación y transporte retrasados. Concluyeron que estas intervenciones no afectan la toma de decisiones clínicas en este caso. (35)
Otro estudio realizado por Chang y col., través de un cuestionario, evaluó el funcionamiento en clínicas de atención primaria en relación con el manejo de la fase preanalítica. Dado que la mayoría de las clínicas no cuentan con laboratorio propio y envían las muestras a laboratorios de referencias, encontraron un funcionamiento inadecuado: el 29.1 % de los encuestados refirió carencia de centrifuga en la clínica, casi la mitad tenía instrucciones sobre el almacenamiento de muestras, y estas eran transportadas una vez al día durante los días laborales. (36)
Eje temático 5: Errores preanalíticos
Nordin y col. (37) observaron que el 82.6 % de los errores preanalíticos son causados por error humano, mientras que los errores técnicos alcanzan el 4.3 %, lo que también concuerda con Van Moll y col., (38) en que los factores humanos fueron más frecuentes (58.7 %) mientras las causas técnicas correspondieron al 12,5%. Además, concuerdan con la literatura en que los errores preanalíticos son más frecuentes que los analíticos y postanalíticos con 77.1 %, 13.5 % y 8 % respectivamente.
Mukhopadhyay y col. realizaron un estudio comparando los errores preanalíticos antes y después de la pandemia de COVID-19, encontrando que la tasa de rechazo de muestras de sangre fue significativamente mayor durante la pandemia (3 % vs. 1.1 %). Las muestras coaguladas fueron el mayor indicador de error preanalítico en ambas etapas, además de un aumento significativo en la tasa de muestras mal etiquetadas. La hemolisis fue el segundo error más común antes de la pandemia y el cuarto durante la pandemia. (39)
Un estudio similar realizado por Eren y col. mostró que las muestras no recibidas fueron significativamente más comunes durante la pandemia, concluyendo que la fase preanalítica fue la más afectada durante la pandemia. (40)
Tashkandi y col., en su estudio sobre un modelo piloto de organización de cuidado avanzado, mencionan que las muestras rechazadas corresponden a 68.3 % por solicitud sin muestra, 6.95 % por uso de tubo incorrecto y 2.85 % por hemólisis. (41)
En el estudio de Alshaghdali y col., del total de muestras analizadas, un 9.3 % presentaron errores preanalíticos, siendo los más comunes las muestras coaguladas (3.6 %) y las muestras no recibidas (3.5 %). (42) Lo primero se repite en el estudio realizado por Kadić y col., donde el porcentaje de error fue de 1.7 % de las muestras y destacando las causas como muestras coaguladas (39.87 %) y hemólisis (48.5%). (43)
El indicador de hemólisis es un error transversal a nivel mundial, como se encontró en el estudio realizado por Zorbozan y Zorbozan, con una tasa de error preanalítico del 0.22 %, destacando muestras con tiempo excesivo de transporte y muestras recolectadas en contenedor incorrecto. (44) Mesganaw y col. también observaron hemólisis como un error principal en su rechazo preanalítico, junto con volumen insuficiente. (45)
Otros estudios han demostrado que los errores pueden ocurrir en distintas etapas de la fase preanalítica. Keppens y col. en la información faltante o incorrecta en el formulario de solicitud (46) y Troiano y col. estudiaron las muestras no recibidas (3.7 %), las que se produjeron principalmente en la sección de emergencia, realizando un seguimiento con entrevistas al personal involucrado para evaluar su causa. (47)
Estudios también han mencionado el problema del ayuno en los exámenes de laboratorios. Kadić y col. encontraron que solo el 37.5 % de los pacientes llegaron preparados adecuadamente al laboratorio. (48)
Los errores de laboratorio no son exclusivos de las muestras de sangre. También hay problemas en la fase preanalítica en la toma de muestras con torulas para cultivos, donde se han evidenciado etiquetados incorrectos en un estudio de Leonard y col. (49) y en muestras de tejidos, como en el estudio de Shinde y Dhanve. (50)
Según Reddy y col., la fase preanalítica es la principal responsable del 97.4 % de los rechazos de muestras serológicas de VIH, siendo la necesidad de una muestra separada la causa más común (57.44 %). Estos errores se atribuyen a deficiencias en la recolección y manejo de muestras, lo genera un aumento de costos y representa el 82.6 % del total de rechazos. Además, se destaca la necesidad de mejorar el entrenamiento del personal de salud para minimizar estos errores, mejorar la eficiencia del laboratorio, reducir costos y asegurar resultados diagnósticos precisos y oportunos. (51)
Šálek et al. observan que solo el 67 % de los laboratorios especificaron el tipo de tubo de muestreo en sus formularios de solicitud, lo que es fundamental para evitar errores preanalíticos, como la absorción de fármacos por los geles de separación del suero. Además, se observa que la entrada manual de datos desde formularios en papel a sistemas electrónicos es propensa a errores de transcripción, lo que puede comprometer la calidad de los resultados. Estas deficiencias en la fase preanalítica subrayan la necesidad de mejorar la armonización y las prácticas de monitoreo terapéutico de fármacos en los laboratorios. (24)
Conclusiones
Los errores preanalíticos de laboratorio son un problema transversal a nivel mundial, en el cual varias organizaciones internacionales han estudiado directrices para realizar un buen proceso en sus diversas etapas. Dentro de las distintas etapas del ciclo del examen la etapa preanalítica es la que tiene el mayor porcentaje de error, esto se asocia a la gran cantidad de participantes en esta etapa y a los errores humanos que podrían provocar.
Es importante destacar que la mayoría de los errores de la etapa preanalítica son evitables con la adecuada capacitación del personal de salud involucrado. La mejora de estos errores preanalíticos sería fundamental en el ciclo del examen, ya que esto involucraría beneficios para el personal, para los pacientes y también para los establecimientos de salud.
Refeencias bibliográficas:
1. Ribaut J. Moving eHealth powered medication adherence interventions from trial to real world as part of the SMILe implementation science project. (Tesis doctoral). Basilea, Suiza: University of Basel; 2023. Disponible en: https://edoc.unibas.ch/94999/
2. Carroll A. It's High Time to Normalize Pre-Visit Lab Testing. Patient Care (Online). 2023. Disponible en: https://go.gale.com/ps/i.do?id=GALE%7CA777405182&sid=googleScholar&v=2.1&it=r&linkaccess=abs&issn=19391897&p=AONE&sw=w.
3. Gherghe G, Uscatescu V, Popa DC. Overview of ADAMTS13 Protein in Diagnosis and Patient Management of TTP. Revista Romana de Hematologie si Medicina Transfuzionala. 2024;2(1):5-11. doi: 10.59854/dhrrh.2024.2.1.5
4. Greaves RF, Gruson D. Six years of progress–highlights from the IFCC Emerging Technologies Division. Clinical Chemistry and Laboratory Medicine. 2024;62(10):1877-1879. doi: 10.1515/cclm-2024-0922
5. International Organization for Standardization (ISO). ISO 15189:2012 Medical laboratories — Requirements for quality and competence. Ginebra, Suiza: ISO; 2012.
6. International Organization for Standardization. ISO 15189:2022 Medical laboratories — Requirements for quality and competence. Geneva: ISO; 2022.
7. World Health Organization. Patient Safety: Making health care safer. Ginebra, Suiza: WHO; 2017.
8. International Organization for Standardization. ISO 22367:2020 Medical laboratories — Application of risk management to medical laboratories. Ginebra, Suiza: ISO; 2020.
9. AlHarshan MSH. The Implementation of Quality Management Systems in Laboratory, Nursing, Radiology and Their Impact on Patient Care and Safety. Saudi J Med Pharm Sci. 2023;9(12):802-807. doi: 10.36348/sjmps.2023.v09i12.005
10. Carraro P, Plebani M. Errors in a stat laboratory: types and frequencies 10 years later. Clin Chem. 2007;53(7):1338-1342. doi: 10.1373/clinchem.2007.088344
11. Bohn MK, Augustin R, Chartier L, Devine L, Doshi S., Ginty L., et al. Primer Part 1 - Preparing a laboratory quality improvement project. Clin Biochem. 2024;127-128:110764. doi: 10.1016/j.clinbiochem.2024.110764
12. Badu E, O’Brien AP, Mitchell R. An integrative review on methodological considerations in mental health research – design, sampling, data collection procedure and quality assurance. Arch Public Health. 2019;77:37. doi: 10.1186/s13690-019-0363- z
13. Whittemore R. Making integrative reviews more methodologically coherent. J Adv Nurs. 2019;75(6):1252-1253.
14. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 29:372:n71. doi: 10.1136/bmj.n71.
15. Broome ME. Integrative literature reviews for the development of concepts. In: Rodgers BL, Knafl KA, editors. Concept Development in Nursing: Foundations, Techniques, and Applications. 3rd ed. Philadelphia: Saunders; 2019, p. 231-50.
16. Gonzalez-Padilla DA, Dahm P. Evidence-based urology: understanding GRADE methodology. Eur Urol Focus. 2021;7(1):135-142. doi: 10.1016/j.euf.2020.06.005.
17. Stonys R, Vitkus D. Assessing Non-Laboratory Healthcare Professionals' Attitude towards the Importance of Patient Preparation for Laboratory Tests. Healthcare (Basel). 2024;12(10):989. doi: 10.3390/healthcare12100989
18. Arredondo ME, Aranda E, Astorga R, Brennan-Bourdon LM, Campelo MD, Flores S, et al. Breakfast can Affect Routine Hematology and Coagulation Laboratory Testing: An Evaluation on Behalf of COLABIOCLI WG-PRE-LATAM. TH Open. 2019;3(4):e367-376. doi: 10.1055/s-0039-3401002
19. Lippi G, von Meyer A, Cadamuro J, Simundic AM. PREDICT: a checklist for preventing preanalytical diagnostic errors in clinical trials. Clin Chem Lab Med. 2020;58(4):518-526. doi: 10.1515/cclm-2019-1089
20. Stonys R, Vitkus D. A survey on the practice of phlebotomy in Lithuania and adherence to the EFLM-COLABIOCLI recommendations: continuous training and clear standard operating procedures as tools for better quality. Biochem Med (Zagreb). 2024;34(2):020702. doi: 10.11613/BM.2024.020702
21. Kopcinovic M, Culej L, Jokic J, Bozovic A, Kocijan MI. Laboratory testing of extravascular body fluids: National recommendations on behalf of the Croatian Society of Medical Biochemistry and Laboratory Medicine. Part I - Serous fluids. Biochem Med (Zagreb). 2020;30(1):010502. doi: 10.11613/BM.2020.010502
22. Fenta DA, Ali MM. Factors Affecting Quality of Laboratory Result During Ordering, Handling, and Testing of the Patient's Specimen at Hawassa University College of Medicine and Health Science Comprehensive Specialized Hospital. J Multidiscip Healthc. 2020;13:809-821. doi: 10.2147/JMDH.S264671
23. Kadić D, Avdagić-Ismić A, Hasić S, Bošnjak F. Fasting state requirements for blood sampling: a survey of patients in Cantonal Hospital Zenica, Bosnia and Herzegovina. Med Glas (Zenica). 2021;18(2):352-356. doi: 10.392/1347-21
24. Šálek T, Schneiderka P, Studená B, Votroubková M. Survey on request form content and result reporting in therapeutic drug monitoring service among laboratories in Czechia and Slovakia. Biochem Med (Zagreb). 2020;30(2):020706. doi: 10.11613/BM.2020.020706
25. Compton CC, Robb JA, Anderson MW, Berry AB, Birdsong GG, Bloom KJ, et al. Preanalytics and Precision Pathology: Pathology Practices to Ensure Molecular Integrity of Cancer Patient Biospecimens for Precision Medicine. Arch Pathol Lab Med. 2019;143(11):1346-63. doi: 10.5858/arpa.2019-0009-SA.
26. García-Del-Pino I, Bauça JM, Gómez C, Caballero A, Llopis MA, Ibarz M, et al. Preanalytical issues related to routine and diagnostic glucose tests: Results from a survey in Spain. Biochem Med (Zagreb). 2020;30(1):010704. doi: 10.11613/BM.2020.010704
27. de Laat-Kremers RMW, Ninivaggi M, Devreese KMJ, de Laat B. Towards standardization of thrombin generation assays: Inventory of thrombin generation methods based on results of an International Society of Thrombosis and Haemostasis Scientific Standardization Committee survey. J Thromb Haemost. 2020;18(8):1893-1899. doi: 10.1111/jth.14863
28. Simundic AM, Baird G, Cadamuro J, Costelloe SJ, Lippi G. Managing hemolyzed samples in clinical laboratories. Crit Rev Clin Lab Sci. 2019;57(1):1-21. doi: 10.1080/10408363.2019.1664391
29. Grankvist K, Gomez R, Nybo M, Lima-Oliveira G, von Meyer A. Preanalytical aspects on short- and long-term storage of serum and plasma. Diagnosis (Berl). 2019;6(1):51-56. doi: 10.1515/dx-2018-0037
30. Niedrist T, Kriegl L, Zurl CJ, Schmidt F, Perkmann-Nagele N, Mucher P, et al. Preanalytical stability of SARS-CoV-2 anti-nucleocapsid antibodies. Clin Chem Lab Med. 2022;61(2):332-338. doi: 10.1515/cclm-2022-0875
31. Codish S, Amichay D, Yitshak-Sade M, Gat R, Liberty IF, Novack L. Improvement of Blood Samples Preanalytic Management Alters the Clinical Results of Glucose Values: Population Study. J Diabetes Sci Technol. 2020;14(2):284–9. doi: 10.1177/1932296818823780
32. Potter JM, Hickman PE, Oakman C, Woods C, Nolan CJ. Strict Preanalytical Oral Glucose Tolerance Test Blood Sample Handling Is Essential for Diagnosing Gestational Diabetes Mellitus. Diabetes Care. 2020;43(7):1438-1441. doi: 10.2337/dc20-0304
33. Ottestad W, Rognes IN, Skaga E, Frisvoll C, Haraldsen G, Eken T, Lundbäck P. HMGB1 concentration measurements in trauma patients: assessment of pre-analytical conditions and sample material. Mol Med. 2020;26:5. doi: 10.1186/s10020-019-0131-0.
34. Grzych G, Roland E, Lezier D, Beauvais D, Maboudou P, Lippi G. Pneumatic tube system transport and false hyperkalemia related to leukocytosis: a retrospective analysis. Ann Biol Clin (Paris). 2019;77(3):281-286. doi: 10.1684/abc.2019.1444
35. Cool L, Callewaert N, Pottel H, Mols R, Lefebvre T, Tack L, et al. Quality of blood samples collected at home does not affect clinical decision making for the administration of systemic cancer treatment. Scand J Clin Lab Invest. 2020;80(3):215-221. doi: 10.1080/00365513.2020.1716267
36. Chang J, Lim J, Chung JW, Sohn YH, Jang MJ, Kim S. Status of Pre-analytical Quality Management of Laboratory Tests at Primary Clinics in Korea. Ann Lab Med. 2023;43(5):493-502. doi: 10.3343/alm.2023.43.5.493
37. Nordin N, Ab Rahim SN, Wan Omar WFA, Zulkarnain S, Sinha S, Kumar S, et al. Preanalytical Errors in Clinical Laboratory Testing at a Glance: Source and Control Measures. Cureus. 2024;16(3):e57243. doi: 10.7759/cureus.57243
38. Van Moll C, Egberts T, Wagner C, Zwaan L, Ten Berg M. The Nature, Causes, and Clinical Impact of Errors in the Clinical Laboratory Testing Process Leading to Diagnostic Error: A Voluntary Incident Report Analysis. J Patient Saf. 2023 Dec 1;19(8):573-579. doi: 10.1097/PTS.0000000000001166. Epub 2023 Sep 28. PMID: 37796227; PMCID: PMC10662575.
39. Mukhopadhyay T, Subramanian A, Pandey S, Madaan N, Trikha A, Malhotra R. The rise in preanalytical errors during COVID-19 pandemic. Biochem Med (Zagreb). 2021;31(2):020710. doi: 10.11613/BM.2021.020710
40. Eren F, Tuncay ME, Oguz EF, Neselioglu S, Erel O. The response of total testing process in clinical laboratory medicine to COVID-19 pandemic. Biochem Med (Zagreb). 2021;31(2):020713. doi: 10.11613/BM.2021.020713
41. Tashkandi SA, Alenezi A, Bakhsh I, AlJuryyan A, AlShehry ZH, AlRashdi S, et al. Clinical laboratory services for primary healthcare centers in urban cities: a pilot ACO model of ten primary healthcare centers. BMC Fam Pract. 2021;22(1):105. doi: 10.1186/s12875-021-01449-1
42. Alshaghdali K, Alcantara TY, Rezgui R, Cruz CP, Alshammary MH, Almotairi YA, et al. Detecting Preanalytical Errors Using Quality Indicators in a Hematology Laboratory. Qual Manag Health Care. 2022;31(3):176-183. doi: 10.1097/QMH.0000000000000343
43. Kadić D, Avdagić Ismić A, Hasić S. The prevalence of pre-analytical errors in the laboratory of the Cantonal Hospital Zenica in Bosnia and Herzegovina. Med Glas (Zenica). 2019;16(1):1-6. doi: 10.17392/979-19
44. Zorbozan N, Zorbozan O. Evaluation of preanalytical and postanalytical phases in clinical biochemistry laboratory according to IFCC laboratory errors and patient safety specifications. Biochem Med (Zagreb). 2022;32(3):030701. doi: 10.11613/BM.2022.030701
45. Mesganaw B, Hassen F, Molla H, Misganaw K. Laboratory specimen rejection rate and associated factors among referred specimens at Debre Markos Referral Hospital, Ethiopia: prospective cross-sectional study. Pan Afr Med J. 2024;47:112. doi: 10.11604/pamj.2024.47.112.33795
46. Keppens C, Van Royen Y, Brysse A, Cotteret S, Høgdall E, Kuhlmann TP, et al. Incidents in Molecular Pathology: Frequency and Causes During Routine Testing. Arch Pathol Lab Med. 2021;145(10):1270-1279. doi: 10.5858/arpa.2020-0152-OA.
47. Troiano G, Nante N, Fanelli A, Rossolini GM, Pecile P, Bordonaro P, et al. The experience of Careggi Hospital (Florence) regarding Not Received Samples (NRS): a pilot study of Risk Management in the Clinical Laboratory. J Prev Med Hyg. 2020;61(1):E6-E8. doi: 10.15167/2421-4248/jpmh2020.61.1.1218
48. Kadić D, Avdagić-Ismić A, Hasić S, Bošnjak F. Fasting state requirements for blood sampling: a survey of patients in Cantonal Hospital Zenica, Bosnia and Herzegovina. Med Glas (Zenica). 2021;18(2):352-356. doi: 10.17392/1347-21
49. Leonard SH, Chin-Yee I, Delport J, Crozier A, Abdulsatar F. Improving wound swab collection in paediatric patients: a quality improvement project. BMJ Open Qual. 2023;12(3):e002170. doi: 10.1136/bmjoq-2022-002170
50. Shinde SV, Dhanve MJ. Audit in surgical histopathology at a tertiary healthcare center: Study of preanalytical and analytical phase. Indian J Pathol Microbiol. 2021;64(1):136-139. doi: 10.4103/IJPM.IJPM_640_20
51. Reddy B, Cassim N, Treurnicht F, Makatini Z. Factors influencing the high rejection rates of HIV 1/2 serology samples at Charlotte Maxeke Johannesburg Academic Hospital and the cost implications. S Afr J HIV Med. 2022;23(1):1326. doi: 10.4102/sajhivmed.v23i1.1326
Cómo citar: Azocar González I, González-González ML, Sepúlveda Maturana F, Azocar González C, Ramírez-Pereira M. Errores preanalíticos en laboratorios clínicos: revisión integrativa. Enfermería: Cuidados Humanizados. 2024;13(2):e4223. doi: 10.22235/ech.v13i2.4223
Contribución de los autores (Taxonomía CRediT): 1. Conceptualización; 2. Curación de datos; 3. Análisis formal; 4. Adquisición de fondos; 5. Investigación; 6. Metodología; 7. Administración de proyecto; 8. Recursos; 9. Software; 10. Supervisión; 11. Validación; 12. Visualización; 13. Redacción: borrador original; 14. Redacción: revisión y edición.
I. A. G. ha contribuido en 1, 2, 3, 5, 6, 7, 9, 10, 11, 12, 13, 14; M. L. G. G. en 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14; F. S. M. en 2, 3, 5, 6, 12, 13; C. A. G. en 2, 3, 5, 6, 12, 13; M. R. P. en 1, 3, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14.
Editora científica responsable: Dra. Natalie Figueredo.
10.22235/ech.v13i2.4223
Original Articles
Pre-analytical Errors in Clinical Laboratories: An Integrative Review
Errores preanalíticos en laboratorios clínicos: revisión integrativa
Erros pré-analíticos em laboratórios clínicos: revisão integrativa
Ignacio Azocar González1 ORCID 0009-0001-7993-7108
María Loreto González-González2 ORCID 0009-0001-5628-0502
Francisca Sepúlveda Maturana3 ORCID 0009-0004-7184-5331
Claudia Azocar González4 ORCID 0009-0003-6305-9050
Mirliana Ramírez-Pereira5 ORCID 0000-0003-1439-4162
1 Universidad Diego Portales, Chile
2 Hospital Claudio Vicuña, Chile
3 Universidad Diego Portales, Chile
4 Independent researcher, Chile
5 Universidad de Chile, Chile, [email protected]
Abstract:
Introduction: Adequate management of the
preanalytical phase is crucial for nursing professionals because it guarantees
the accuracy and reliability of laboratory results, which are essential for
effective diagnosis and treatment.
Objective: To identify preanalytical errors in clinical laboratories in
the available literature.
Methodology: Integrative review through PubMed, Scopus and Scielo
databases. PRISMA criteria were used to select and evaluate relevant studies
published between 2019 and 2024. Selected studies were critically appraised and
synthesized using the constant comparison method: data reduction, data
visualization, data comparison, drawing conclusions.
Results: The initially identified articles were 80 (PubMed = 66, Scopus
= 14, Scielo = 0) and 34 studies that met the selection criteria for this
review were included. Pre-analytical errors are identified as predominant,
representing a high percentage of errors in the laboratory, with poor sample
preparation and handling being the most common causes. These errors increase
costs and compromise diagnostic quality.
Conclusion: Standardization of procedures and staff training are
essential to reduce these errors and improve patient safety.
Keywords: blood chemical analysis; quality of health care; pre-analytical phase; laboratory test.
Resumen:
Introducción: Un adecuado manejo de la fase
preanalítica es crucial para los profesionales de enfermería porque garantiza
la precisión y confiabilidad de los resultados de laboratorio, fundamentales
para diagnósticos y tratamientos efectivos.
Objetivo: Identificar en la literatura disponible los errores
preanalíticos en laboratorios clínicos.
Metodología: Revisión integrativa a través de las bases de datos PubMed,
Scopus y Scielo. Se utilizaron los criterios PRISMA para seleccionar y evaluar
estudios relevantes publicados entre 2019 y 2024. Los estudios seleccionados
fueron evaluados críticamente y sintetizados utilizando el método de
comparación constante: reducción de datos, visualización de datos, comparación
de datos, elaboración de conclusiones.
Resultados: Los artículos identificados inicialmente fueron 80 (PubMed =
66, Scopus = 14, Scielo = 0) y se incluyeron 34 estudios que cumplieron los
criterios de selección para esta revisión. Se identifica que los errores
preanalíticos son predominantes, representando un alto porcentaje de errores en
el laboratorio, siendo la mala preparación y manejo de muestras las causas más
comunes. Estos errores aumentan los costos y comprometen la calidad
diagnóstica.
Conclusión: La estandarización de procedimientos y la capacitación del
personal son esenciales para reducir estos errores y mejorar la seguridad del
paciente.
Palabras clave: análisis químico de la sangre; calidad de la atención de salud; fase preanalítica; prueba de laboratorio.
Resumo:
Introdução: Um manejo adequado da fase
pré-analítica é crucial para os profissionais de enfermagem, pois garante a
precisão e a confiabilidade dos resultados laboratoriais, fundamentais para
diagnósticos e tratamentos eficazes.
Objetivo: Identificar na literatura disponível os erros pré-analíticos
em laboratórios clínicos.
Metodologia: Foi realizada uma revisão integrativa por meio das bases de
dados PubMed, Scopus e Scielo. Foram utilizados os critérios PRISMA para
selecionar e avaliar estudos relevantes publicados entre 2019 e 2024. Os
estudos selecionados foram avaliados criticamente e sintetizados utilizando o
método de comparação constante: redução de dados, visualização de dados,
comparação de dados e elaboração de conclusões.
Resultados: Foram inicialmente identificados 80 artigos (PubMed = 66,
Scopus = 14, Scielo = 0), dos quais 34 estudos cumpriram os critérios de
seleção para esta revisão. Identificou-se que os erros pré-analíticos são
predominantes, representando uma alta porcentagem de erros laboratoriais, sendo
a má preparação e o manejo inadequado de amostras as causas mais comuns. Esses
erros aumentam os custos e comprometem a qualidade diagnóstica.
Conclusão: A padronização de procedimentos e a capacitação da equipe são
essenciais para reduzir esses erros e melhorar a segurança do paciente.
Palavras-chave: análise química do sangue; qualidade da atenção à saúde; fase pré-analítica; testes laboratoriais.
Received: 21/08/2024
Accepted: 24/10/2024
Introduction
Evidence-based practice is the quality instrument that supports clinical practice. Therefore, it is necessary to investigate and review the literature to update concepts and identify strategies that improve the quality of patient care. (1)
This is directly linked to the nursing care role, where a logical and standardized process for blood sample collection in various healthcare contexts is fundamental. (2)
Laboratory medicine is defined as a science that generates clinical information by analyzing the concentration, composition, and/or structure of various analytes in biological fluids, which, thanks to technological and management advances, have made a fundamental contribution to health care with significant contributions in clinical medicine, epidemiological surveillance, and scientific research. (3)
The total analytical process of laboratory tests was defined 50 years ago by George Lundberg as the “brain-to-brain” cycle, and it has been divided into three phases: pre-analytical, analytical, and post-analytical. (4)
ISO 15189:2012 defined the pre-analytical phase as the steps that consider the healthcare personnel’s request, patient preparation, sample collection, transportation to and within the laboratory, and this phase ends with the start of the analysis process. (5)
The International Organization for Standardization (ISO), under ISO 15189:2012, included the definition of thresholds and improvement criteria in pre-analytical quality management. (5) In its update, ISO 15189:2022 established the requirement for clinical laboratories to implement these indicators to monitor and evaluate their performance, ensuring reliable healthcare services. (6)
The World Health Organization (WHO) defines Patient Safety as “the reduction of risk of unnecessary harm associated with healthcare to an acceptable minimum”. (7) The International Organization for Standardization (ISO) defines a laboratory error as: a failed operation during the pre-analytical, analytical, and post-analytical phases of laboratory work that was planned but not completed or performed incorrectly. (8)
It is also worth mentioning that quality indicators, closely related to patient safety, are objective tools that provide solid evidence of quality at all stages of the analysis process, ensuring patient safety by reducing error rates and guaranteeing reliable and accurate results. (9)
A pre-analytical error occurs when laboratory acceptability criteria are not met, such as when an analytical test is not performed or results are not provided, which can lead to sample rejection for not being able to generate reliable results for the requested tests. (10)
Moreover, the literature describes that laboratory errors are common and widespread, affecting patient safety, causing unnecessary stress and anxiety. They also contribute to erroneous or delayed diagnoses, unjustified costs for the patient and the healthcare network, inadequate therapies, repeated samples, unnecessary follow-up investigations, as well as affecting clinical effectiveness, generating patient dissatisfaction, and discrediting the clinical laboratory. (11)
The research problem posed was: What evidence is available on the errors that occur in the pre-analytical phase of clinical laboratory tests? The objective was to identify the available literature on pre-analytical errors in clinical laboratories.
Materials and Methods
An integrative review was conducted to gather and synthesize information that would allow for a broad and deep understanding of this phenomenon. (12, 13) To ensure the quality and transparency of this report, the criteria included in the Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) were used. (14)
The methodological approach guiding this integrative review follows the guidelines proposed by Broome (2019), who emphasizes the importance of integrating various types of evidence to develop robust concepts in the field of nursing. This method allows the inclusion of studies with heterogeneous designs and facilitates a broader and deeper understanding of complex phenomena, such as pre-analytical errors in clinical laboratories. (15)
First, the research question was formulated: What evidence is available on the errors that occur in the pre-analytical phase of clinical laboratory tests? Rigorous inclusion criteria were established to select relevant studies. The articles had to be related to the topic, published in English, Spanish, or Portuguese, available in full text, open-access, and peer-reviewed. Among the limitations of the study are:
- Inclusion criteria limited to open-access articles: This decision restricts access to publications from high-impact journals that could offer more relevant studies or higher methodological quality.
- Temporal limitation of the search (2019-2024): Although this temporal restriction ensures that only recent studies are used, it may also exclude previous research that has provided fundamental data on pre-analytical errors.
- Limited use of databases: While important databases such as PubMed and Scopus were used, the exclusion of other key sources may have restricted the search to a partial view of the available literature. Additionally, no articles were found in Scielo, which may be relevant for studies in specific regions such as Latin America.
- Potential publication bias: By including only peer-reviewed, open-access studies, relevant studies that do not meet these criteria may have been excluded.
The literature search was conducted in databases recognized for their relevance in health and biomedical sciences. These databases included Scielo, PubMed, and Scopus. Additionally, reference lists of relevant articles were reviewed, and specialized organizations on the topic were consulted.
To ensure a comprehensive search strategy, specific terms such as “blood chemical analysis”, “quality of health care”, “pre-analytical phase” and “laboratory test” were used, applied in the title, abstract, or full text of the articles. The complete search strategies were documented for each database, including the filters and limits applied to restrict the results to peer-reviewed studies published within the specified period. The Boolean operator AND was included. The last search in each of these sources was conducted in June 2024.
The study selection process involved a meticulous review to determine if the articles met the inclusion criteria. Two reviewers independently evaluated each record and each retrieved report. Automation tools, such as bibliographic management software, were used for duplicate removal and the initial selection of studies. In case of discrepancies, discussions were held until a consensus was reached. The evaluation of the data by the level of evidence was carried out using the GRADE approach. This process included the assessment of the methodological quality of each study according to previously established criteria, such as study design, result consistency, and clinical applicability. (16)
Data collection from the selected reports was carried out independently by two reviewers, following a standardized protocol. Processes were included to obtain or confirm data directly from the study investigators when necessary, and automation tools were used to facilitate this task. The data were critically evaluated to ensure their validity and relevance. A standardized tool was used to assess the quality of the studies, and each study was evaluated independently by at least two reviewers. The data analysis included the reduction, visualization, comparison, and synthesis of the results. The methods used to tabulate and visually display the results of individual studies and syntheses were described in detail. For each result, the effect measures used, such as risk ratio or mean difference, were specified.
Additionally, the risk of bias in the included studies was assessed, describing the tools employed, the number of reviewers, and their independence in the process. The methods used to assess the certainty or confidence in the body of evidence for each result were detailed.
Finally, the results were presented in a structured manner, in five categories: 1) Patient Preparation, 2) Test Request, 3) Sample Collection, 4) S Sample Storage and Transportation, and 5) Pre-Analytical Errors, highlighting the main conclusions and recommendations for clinical practice and future research. A PRISMA flowchart was used to document the study selection process, showing the number of studies identified, included, and excluded, and the reasons for exclusion.
Results
From the review of the articles, 80 records were initially identified in databases, with 14 from Scopus and 66 from PubMed. No articles related to the topic were found in Scielo. Of these records, 20 were eliminated before the review: 7 due to duplication and 13 due to language. Subsequently, 60 records were reviewed, of which 26 were excluded for not being related to the study topic. Finally, 34 studies were included in the final review (Figure 1).
Figure 1: PRISMA Flowchart: Summary of the Study Selection Process
With the purpose of organizing the data for analysis, a table was created that includes the general information of each article (Table 1). This table details the objective of each study, in order to carry out an inductive categorization based on thematic axes in the next phase.
Table 1: Characteristics of the selected studies
After the content analysis, five thematic axes were identified in which the characteristics of the pre-analytical phase are evident. The categories that emerged are the following:
1. Patient preparation: It consists of the delivery of the prerequisites for taking exams, which will depend on the analyte to be studied.
2. Test Request: Corresponds to the issuance of the request for the examination by the doctor.
3. Sample Collection: A controlled, standardized procedure that involves the collection of blood or other body fluids for clinical analysis, diagnosis, or treatment.
4. Sample Storage and Transportation: Sample storage implies adequate conditions to preserve the stability of the collected samples until the analysis is performed. Sample transfer is the transport from the collection site to the laboratory for analysis.
5. Pre-Analytical Errors: This category corresponds to the failed operation during the preanalytical phase of the laboratory work, which was planned but is not fulfilled or is performed incorrectly. This situation can lead to the rejection of the sample when one or more of the requested results cannot be delivered.
Table 2 shows the different articles grouped according to categories or thematic axes.
Table 2: Thematic axes that emerge from the selected articles
Discussion
The management of laboratory tests is essential for safe and quality care. For this reason, nurses must know the evidence that supports their practice in this area. Below are the thematic axes organized into five categories.
Thematic Axis 1: Patient Preparation
Stonys and Vitkus mention that only a minority of patients tend to arrive well-prepared for blood sample collection, which is a problem in Lithuania. The causes of inadequate preparation include misinformation and variability in recommendations provided by laboratories, which affects the quality of the results . (17) Arredondo evaluated the importance of fasting in hematology and coagulation tests. Samples were taken while fasting, after the consumption of a standardized breakfast of carbohydrates, proteins, and lipids, and then at the first, second, and fourth hours post-consumption. The results showed no return to baseline values in the 4 hours following food intake, leading to the conclusion that, for the analytes included in the study, fasting time should be considered important. (18)
This is corroborated by Lippi et al., who, in their publication on the importance of the pre-analytical phase in clinical studies, emphasized the relevance of patient preparation so that the blood sample effectively reflects the subject’s real conditions. Therefore, it is indicated that precise information should be collected on medication and supplement use, as well as the pathologies affecting the patient, reinforcing the importance of fasting time, the time of sample collection, abstinence from tobacco, avoiding coffee consumption, and refraining from strenuous physical activity for 48 hours. Moreover, patients should be seated for at least 10 minutes before extraction. (19)
Continuing with Lippi, among the important steps he also recommends are the confirmation of the patient’s identity with at least two indicators, defining the sample matrix, specifying the sample volume, applying the tourniquet for less than one minute, defining the venipuncture site, performing venipuncture by phlebotomists, following the recommended order of extraction, and standardizing the mixing of samples. (19)
Stonys and Vitkus, in their study on the attitude and lack of understanding of non-laboratory health professionals about the importance of patient preparation, applied an anonymous questionnaire that revealed that these professionals consider patient preparation in laboratory tests significant, such as fasting, alcohol, tobacco, or medication consumption (nurses more so than doctors). However, the attitude towards the impact of physical activity, the menstrual cycle day, and circadian rhythm showed significant differences depending on years of work experience (more or less than 20 years) and whether they had received relevant training. (20)
Thematic Axis: Test Request
Kopcinovic and colleagues, in their study on body fluid analysis, made a recommendation to professionals involved in the collection and processing of these samples to standardize the procedure at a national level. For this, they conducted a survey and reviewed evidence through the literature, reinforcing the importance of the test request form and order of analysis, which should include: patient’s name and surname, gender, date of birth, unique identifier, date and time of collection, hospital unit, doctor’s identification and contact details, the identifier of the sample taker, collection procedure and site, and the anatomical origin of the sample. (21)
In a study conducted by Fenta and colleagues to evaluate pre-analytical errors, they observed that 87.5 % of the test requests were incomplete regarding clinical diagnosis, 12.5 % did not include gender, and 15 % were missing age. (22) According to Kadic et al, errors in patient identification were associated with a higher occurrence of laboratory errors. In addition, 85 % of the requests did not have the time of sample collection. (23)
A study conducted by Salek and colleagues, which consisted of a survey to investigate test request forms and result reports in the therapeutic drug monitoring service in laboratories, found that only 12 % implemented all the necessary elements for optimal therapeutic drug monitoring. These elements included age, body weight, sample timing, date of first administration, time of last administered dose, dose, dosing interval, route of administration, purpose of the test, and other co-administered medications. (24)
Thematic Axis 3: Sample Collection
Compton and colleagues, in the case of tissues for molecular tests, estimate that the ideal sample thickness is up to 5mm due to the penetration speed of formalin. For blood samples, factors such as the type of collection tube (EDTA tube or specialized tubes for cell stabilization), the tube fill level as per the manufacturer’s recommendation, and the tube order in multiple collections to avoid cross-contamination are emphasized. The recommended order is: tube without additive, coagulation tube with sodium citrate, tube with clot activator, tube with clot activator and serum separator, heparin tube (either sodium heparin or lithium heparin), EDTA tube, and tubes with other additives like citrate, dextrose-acid; oxalate/fluoride, and anti-glycolytic agent. Additionally, an adequate number of inversions should be performed for proper mixing of the analyte with the tube additive. (25)
On the other hand, García del Pino and colleagues, in their study on pre-analytical conditions in glucose tests, sent a survey to different laboratories and observed that the conditions under which the tests were performed were not ideal. The largest percentage of samples was performed in serum tubes, followed by plasma tubes with lithium heparin and plasma tubes with glycolysis inhibitor such as sodium fluoride on a smaller scale (19 %). The importance of the selected serum tube does not meet the conditions of the fasting plasma glucose diagnostic criteria. (26)
De Laat-Kremers and colleagues observed significant diversity among laboratories in the pre-analytical phase for thrombin generation measurement. They conducted a study through a questionnaire to laboratories in different locations around the world to understand these differences. 68 % of laboratories use only platelet-poor plasma, 4 % use only platelet-rich plasma, 24 % combine both types, 1 % use whole blood, and 3 % combine all three types. 40 % draw blood using a butterfly needle, and 39 % with a straight needle. 73 % use plastic collection tubes and 14 % use glass. The preferred anticoagulant is trisodium citrate (83 %), and 71 % discard the first blood tube. (27)
Simundic and colleagues observed that among the most important causes of hemolysis during phlebotomy were the use of inadequate equipment, such as syringes instead of evacuated tubes, needle diameter favoring turbulent flow, blood transfer from the syringe to the collection tube, and blood tubes with less volume than recommended. Phlebotomy from the antecubital fossa and gentle mixing of the tubes is recommended. (28)
The importance of documenting collection time is emphasized by Grankvist and colleagues in their study, as several factors can influence the integrity of biomarkers in serum and plasma samples. In the clinical biochemistry laboratory, samples are usually kept in their collection tubes until analysis, pending transport to the laboratory. Many analytes are stable for several hours without centrifugation; however, unstable ones require centrifugation and refrigerated transport or, in some cases, freezing before analysis. This is important to consider in peripheral sample collection centers, which should have supplies available to perform these pre-transport procedures. The stability of the analyte must be ensured by the laboratory. Laboratories requiring long-term storage should redouble their efforts to manage pre-analytical variations such as fasting, medication instructions, collection time restrictions, sample volume, maximum centrifugation time, and freezing. (29)
Thematic Axis 4: Sample Storage and Transportation
Niedrist et al. evaluated the impact of routine storage time and temperature conditions on anti-nucleocapsid (NC) antibodies, finding that their levels after approximately 3 months at less than -70°C or during 14 days at temperatures between 2-10°C did not decrease significantly from a statistical standpoint. However, for storage periods longer than 1.5 years, relevant deviations were observed, potentially increasing positivity rates in convalescent COVID-19 patients. (30)
Codish et al. reported that prolonged time between blood extraction and the separation of the cell mass can decrease glucose levels, influencing the diagnosis of hyperglycemia and hypoglycemia. Through the evaluation of fasting glucose tests in an adult population before and after an educational intervention, the establishment of five centrifugation centers at key city locations, and changes in transportation routes, samples were kept in insulated coolers with polystyrene at 20°C for a maximum of 2 hours until centrifugation. The transportation temperature was monitored using a barcode tracking system. After the implementation of these changes, glucose results over 100 mg/dL increased significantly from 9.83 % to 25.91 %, and hypoglycemia (below 50 mg/dL) decreased. (31)
Another study on glucose variation was conducted by Potter et al. on pregnant women. In a protocol of delayed centrifugation versus early centrifugation (within 10 minutes of sample collection), higher glucose levels were obtained with early centrifugation, demonstrating variation in the rate of gestational diabetes diagnosis depending on the centrifugation time. (32)
Ottestad et al. conducted a study to evaluate the pre-analytical handling of HMGB1 (a mediator of systemic inflammation in sepsis and trauma) by taking arterial and venous samples, with delayed centrifugation times of 15 minutes, 3, 6, 12, and 24 hours stored at room temperature. They found that the samples were stable up to 6 hours, and arterial samples presented 40 % lower concentrations than venous samples. (33)
A study by Grzych et al. also evaluated this type of transportation, suggesting that plasma potassium levels can be influenced, which could lead to erroneous diagnoses. (34) Cool et al. explored whether pre-analytical quality was affected in blood samples taken at the homes of cancer patients undergoing treatment due to delayed centrifugation and transportation. They concluded that these interventions do not affect clinical decision-making in this case. (35)
Another study conducted by Chang et al. used a questionnaire to evaluate the functioning of primary care clinics in relation to pre-analytical phase management. Since most clinics do not have their own laboratories and send samples to reference laboratories, inadequate practices were found: 29.1 % of respondents reported a lack of centrifuges at the clinic, almost half had instructions on sample storage, and the samples were transported once a day during workdays. (36)
Thematic axis 5: Pre-Analytical Errors
Nordin et al. (37) observed that 82.6 % of pre-analytical errors are caused by human error, while technical errors account for 4.3 %, which is also consistent with Van Moll et al., (38) who found that human factors were more frequent (58.7 %) while technical causes accounted for 12.5 %. Additionally, they agree with the literature that pre-analytical errors are more frequent than analytical and post-analytical errors, with rates of 77.1 %, 13.5 %, and 8 %, respectively.
Mukhopadhyay et al. conducted a study comparing pre-analytical errors before and after the COVID-19 pandemic, finding that the rejection rate for blood samples was significantly higher during the pandemic (3 % vs. 1.1 %). Coagulated samples were the most common indicator of pre-analytical error in both stages, along with a significant increase in the rate of mislabeled samples. Hemolysis was the second most common error before the pandemic and the fourth most common during the pandemic. (39)
A similar study conducted by Eren et al. showed that samples not received were significantly more common during the pandemic, concluding that the pre-analytical phase was the most affected during the pandemic. (40)
Tashkandi et al., in their study on a pilot model of Advanced Care Organization, mentioned that rejected samples corresponded to 68.3 % for requests without a sample, 6.95 % for incorrect tube usage, and 2.85 % for hemolysis. (41)
In the study by Alshadhdali et al., of the total samples analyzed, 9.3 % presented pre-analytical errors, with the most common being coagulated samples (3.6 %) and samples not received (3.5 %). (42) The former is repeated in the study conducted by Kadic et al., where the error rate was 1.7 % of samples, with the causes being coagulated samples (39.87 %) and hemolysis (48.5 %). (43)
Hemolysis is a widespread error worldwide, as found in the study conducted by Zorbozan and Zorbozan, with a pre-analytical error rate of 0.22 %, highlighting samples with excessive transport time and samples collected in incorrect containers. (44) Mesganaw et al. also observed hemolysis as a primary error in pre-analytical rejection, along with insufficient volume. (45)
Other studies have shown that errors can occur at different stages of the pre-analytical phase. Keppens et al. noted missing or incorrect information on the test request form, (46) and Troiano et al. studied samples not received (3.7 %), which mostly occurred in the emergency department, following up with interviews with the involved staff to evaluate the cause. (47)
Studies have also mentioned the issue of fasting in laboratory tests. Kadic et al. found that only 37.5 % of patients arrived adequately prepared at the laboratory. (48)
Laboratory errors are not exclusive to blood samples. There are also pre-analytical phase problems in the collection of culture swabs, where incorrect labeling has been evidenced in a study by Leonard et al. (49) and in tissue samples, as seen in the study by Shinde and Dhanve. (50)
According to Reddy et al., the pre-analytical phase is mainly responsible for 97.4 % of the rejections of HIV serology samples, with the need for a separate sample being the most common cause (57.44 %). These errors are attributed to deficiencies in sample collection and handling, leading to increased costs and representing 82.6 % of total rejections. Additionally, the need to improve healthcare staff training is highlighted to minimize these errors, improve laboratory efficiency, reduce costs, and ensure accurate and timely diagnostic results. (51)
Šálek et al. observed that only 67 % of laboratories specified the type of sampling tube on their request forms, which is critical to avoiding pre-analytical errors, such as drug absorption by serum separator gels. Furthermore, it was observed that the manual entry of data from paper forms into electronic systems is prone to transcription errors, which can compromise result quality. These deficiencies in the pre-analytical phase underscore the need to improve harmonization and therapeutic drug monitoring practices in laboratories. (24)
Conclusions
Pre-analytical laboratory errors are a widespread global issue, in which several international organizations have studied guidelines to ensure a good process in its various stages. Among the different stages of the testing cycle, the pre-analytical phase has the highest percentage of errors, which is associated with the large number of participants involved in this stage and the human errors that may occur.
It is important to highlight that most pre-analytical stage errors are avoidable with proper training of the healthcare personnel involved. Improving these pre-analytical errors would be fundamental to the testing cycle, as it would bring benefits to the staff, patients, and healthcare facilities.
Bibliographical references:
1. Ribaut J. Moving eHealth powered medication adherence interventions from trial to real world as part of the SMILe implementation science project. (Doctoral Dissertation). Basilea, Suiza: University of Basel; 2023. Available from: https://edoc.unibas.ch/94999/
2. Carroll A. It’s High Time to Normalize Pre-Visit Lab Testing. Patient Care (Online). 2023. Available from: https://go.gale.com/ps/i.do?id=GALE%7CA777405182&sid=googleScholar&v=2.1&it=r&linkaccess=abs&issn=19391897&p=AONE&sw=w.
3. Gherghe G, Uscatescu V, Popa DC. Overview of ADAMTS13 Protein in Diagnosis and Patient Management of TTP. Revista Romana de Hematologie si Medicina Transfuzionala. 2024;2(1):5-11. doi: 10.59854/dhrrh.2024.2.1.5
4. Greaves RF, Gruson D. Six years of progress–highlights from the IFCC Emerging Technologies Division. Clinical Chemistry and Laboratory Medicine. 2024;62(10):1877-1879. doi: 10.1515/cclm-2024-0922
5. International Organization for Standardization (ISO). ISO 15189:2012 Medical laboratories — Requirements for quality and competence. Ginebra, Suiza: ISO; 2012.
6. International Organization for Standardization. ISO 15189:2022 Medical laboratories — Requirements for quality and competence. Geneva: ISO; 2022.
7. World Health Organization. Patient Safety: Making health care safer. Ginebra, Suiza: WHO; 2017.
8. International Organization for Standardization. ISO 22367:2020 Medical laboratories — Application of risk management to medical laboratories. Ginebra, Suiza: ISO; 2020.
9. AlHarshan MSH. The Implementation of Quality Management Systems in Laboratory, Nursing, Radiology and Their Impact on Patient Care and Safety. Saudi J Med Pharm Sci. 2023;9(12):802-807. doi: 10.36348/sjmps.2023.v09i12.005
10. Carraro P, Plebani M. Errors in a stat laboratory: types and frequencies 10 years later. Clin Chem. 2007;53(7):1338-1342. doi: 10.1373/clinchem.2007.088344
11. Bohn MK, Augustin R, Chartier L, Devine L, Doshi S., Ginty L., et al. Primer Part 1 - Preparing a laboratory quality improvement project. Clin Biochem. 2024;127-128:110764. doi: 10.1016/j.clinbiochem.2024.110764
12. Badu E, O’Brien AP, Mitchell R. An integrative review on methodological considerations in mental health research – design, sampling, data collection procedure and quality assurance. Arch Public Health. 2019;77:37. doi: 10.1186/s13690-019-0363- z
13. Whittemore R. Making integrative reviews more methodologically coherent. J Adv Nurs. 2019;75(6):1252-1253.
14. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 29:372:n71. doi: 10.1136/bmj.n71.
15. Broome ME. Integrative literature reviews for the development of concepts. In: Rodgers BL, Knafl KA, editors. Concept Development in Nursing: Foundations, Techniques, and Applications. 3rd ed. Philadelphia: Saunders; 2019, p. 231-50.
16. Gonzalez-Padilla DA, Dahm P. Evidence-based urology: understanding GRADE methodology. Eur Urol Focus. 2021;7(1):135-142. doi: 10.1016/j.euf.2020.06.005.
17. Stonys R, Vitkus D. Assessing Non-Laboratory Healthcare Professionals’ Attitude towards the Importance of Patient Preparation for Laboratory Tests. Healthcare (Basel). 2024;12(10):989. doi: 10.3390/healthcare12100989
18. Arredondo ME, Aranda E, Astorga R, Brennan-Bourdon LM, Campelo MD, Flores S, et al. Breakfast can Affect Routine Hematology and Coagulation Laboratory Testing: An Evaluation on Behalf of COLABIOCLI WG-PRE-LATAM. TH Open. 2019;3(4):e367-376. doi: 10.1055/s-0039-3401002
19. Lippi G, von Meyer A, Cadamuro J, Simundic AM. PREDICT: a checklist for preventing preanalytical diagnostic errors in clinical trials. Clin Chem Lab Med. 2020;58(4):518-526. doi: 10.1515/cclm-2019-1089
20. Stonys R, Vitkus D. A survey on the practice of phlebotomy in Lithuania and adherence to the EFLM-COLABIOCLI recommendations: continuous training and clear standard operating procedures as tools for better quality. Biochem Med (Zagreb). 2024;34(2):020702. doi: 10.11613/BM.2024.020702
21. Kopcinovic M, Culej L, Jokic J, Bozovic A, Kocijan MI. Laboratory testing of extravascular body fluids: National recommendations on behalf of the Croatian Society of Medical Biochemistry and Laboratory Medicine. Part I - Serous fluids. Biochem Med (Zagreb). 2020;30(1):010502. doi: 10.11613/BM.2020.010502
22. Fenta DA, Ali MM. Factors Affecting Quality of Laboratory Result During Ordering, Handling, and Testing of the Patient’s Specimen at Hawassa University College of Medicine and Health Science Comprehensive Specialized Hospital. J Multidiscip Healthc. 2020;13:809-821. doi: 10.2147/JMDH.S264671
23. Kadić D, Avdagić-Ismić A, Hasić S, Bošnjak F. Fasting state requirements for blood sampling: a survey of patients in Cantonal Hospital Zenica, Bosnia and Herzegovina. Med Glas (Zenica). 2021;18(2):352-356. doi: 10.392/1347-21
24. Šálek T, Schneiderka P, Studená B, Votroubková M. Survey on request form content and result reporting in therapeutic drug monitoring service among laboratories in Czechia and Slovakia. Biochem Med (Zagreb). 2020;30(2):020706. doi: 10.11613/BM.2020.020706
25. Compton CC, Robb JA, Anderson MW, Berry AB, Birdsong GG, Bloom KJ, et al. Preanalytics and Precision Pathology: Pathology Practices to Ensure Molecular Integrity of Cancer Patient Biospecimens for Precision Medicine. Arch Pathol Lab Med. 2019;143(11):1346-63. doi: 10.5858/arpa.2019-0009-SA.
26. García-Del-Pino I, Bauça JM, Gómez C, Caballero A, Llopis MA, Ibarz M, et al. Preanalytical issues related to routine and diagnostic glucose tests: Results from a survey in Spain. Biochem Med (Zagreb). 2020;30(1):010704. doi: 10.11613/BM.2020.010704
27. de Laat-Kremers RMW, Ninivaggi M, Devreese KMJ, de Laat B. Towards standardization of thrombin generation assays: Inventory of thrombin generation methods based on results of an International Society of Thrombosis and Haemostasis Scientific Standardization Committee survey. J Thromb Haemost. 2020;18(8):1893-1899. doi: 10.1111/jth.14863
28. Simundic AM, Baird G, Cadamuro J, Costelloe SJ, Lippi G. Managing hemolyzed samples in clinical laboratories. Crit Rev Clin Lab Sci. 2019;57(1):1-21. doi: 10.1080/10408363.2019.1664391
29. Grankvist K, Gomez R, Nybo M, Lima-Oliveira G, von Meyer A. Preanalytical aspects on short- and long-term storage of serum and plasma. Diagnosis (Berl). 2019;6(1):51-56. doi: 10.1515/dx-2018-0037
30. Niedrist T, Kriegl L, Zurl CJ, Schmidt F, Perkmann-Nagele N, Mucher P, et al. Preanalytical stability of SARS-CoV-2 anti-nucleocapsid antibodies. Clin Chem Lab Med. 2022;61(2):332-338. doi: 10.1515/cclm-2022-0875
31. Codish S, Amichay D, Yitshak-Sade M, Gat R, Liberty IF, Novack L. Improvement of Blood Samples Preanalytic Management Alters the Clinical Results of Glucose Values: Population Study. J Diabetes Sci Technol. 2020;14(2):284–9. doi: 10.1177/1932296818823780
32. Potter JM, Hickman PE, Oakman C, Woods C, Nolan CJ. Strict Preanalytical Oral Glucose Tolerance Test Blood Sample Handling Is Essential for Diagnosing Gestational Diabetes Mellitus. Diabetes Care. 2020;43(7):1438-1441. doi: 10.2337/dc20-0304
33. Ottestad W, Rognes IN, Skaga E, Frisvoll C, Haraldsen G, Eken T, Lundbäck P. HMGB1 concentration measurements in trauma patients: assessment of pre-analytical conditions and sample material. Mol Med. 2020;26:5. doi: 10.1186/s10020-019-0131-0.
34. Grzych G, Roland E, Lezier D, Beauvais D, Maboudou P, Lippi G. Pneumatic tube system transport and false hyperkalemia related to leukocytosis: a retrospective analysis. Ann Biol Clin (Paris). 2019;77(3):281-286. doi: 10.1684/abc.2019.1444
35. Cool L, Callewaert N, Pottel H, Mols R, Lefebvre T, Tack L, et al. Quality of blood samples collected at home does not affect clinical decision making for the administration of systemic cancer treatment. Scand J Clin Lab Invest. 2020;80(3):215-221. doi: 10.1080/00365513.2020.1716267
36. Chang J, Lim J, Chung JW, Sohn YH, Jang MJ, Kim S. Status of Pre-analytical Quality Management of Laboratory Tests at Primary Clinics in Korea. Ann Lab Med. 2023;43(5):493-502. doi: 10.3343/alm.2023.43.5.493
37. Nordin N, Ab Rahim SN, Wan Omar WFA, Zulkarnain S, Sinha S, Kumar S, et al. Preanalytical Errors in Clinical Laboratory Testing at a Glance: Source and Control Measures. Cureus. 2024;16(3):e57243. doi: 10.7759/cureus.57243
38. Van Moll C, Egberts T, Wagner C, Zwaan L, Ten Berg M. The Nature, Causes, and Clinical Impact of Errors in the Clinical Laboratory Testing Process Leading to Diagnostic Error: A Voluntary Incident Report Analysis. J Patient Saf. 2023 Dec 1;19(8):573-579. doi: 10.1097/PTS.0000000000001166. Epub 2023 Sep 28. PMID: 37796227; PMCID: PMC10662575.
39. Mukhopadhyay T, Subramanian A, Pandey S, Madaan N, Trikha A, Malhotra R. The rise in preanalytical errors during COVID-19 pandemic. Biochem Med (Zagreb). 2021;31(2):020710. doi: 10.11613/BM.2021.020710
40. Eren F, Tuncay ME, Oguz EF, Neselioglu S, Erel O. The response of total testing process in clinical laboratory medicine to COVID-19 pandemic. Biochem Med (Zagreb). 2021;31(2):020713. doi: 10.11613/BM.2021.020713
41. Tashkandi SA, Alenezi A, Bakhsh I, AlJuryyan A, AlShehry ZH, AlRashdi S, et al. Clinical laboratory services for primary healthcare centers in urban cities: a pilot ACO model of ten primary healthcare centers. BMC Fam Pract. 2021;22(1):105. doi: 10.1186/s12875-021-01449-1
42. Alshaghdali K, Alcantara TY, Rezgui R, Cruz CP, Alshammary MH, Almotairi YA, et al. Detecting Preanalytical Errors Using Quality Indicators in a Hematology Laboratory. Qual Manag Health Care. 2022;31(3):176-183. doi: 10.1097/QMH.0000000000000343
43. Kadić D, Avdagić Ismić A, Hasić S. The prevalence of pre-analytical errors in the laboratory of the Cantonal Hospital Zenica in Bosnia and Herzegovina. Med Glas (Zenica). 2019;16(1):1-6. doi: 10.17392/979-19
44. Zorbozan N, Zorbozan O. Evaluation of preanalytical and postanalytical phases in clinical biochemistry laboratory according to IFCC laboratory errors and patient safety specifications. Biochem Med (Zagreb). 2022;32(3):030701. doi: 10.11613/BM.2022.030701
45. Mesganaw B, Hassen F, Molla H, Misganaw K. Laboratory specimen rejection rate and associated factors among referred specimens at Debre Markos Referral Hospital, Ethiopia: prospective cross-sectional study. Pan Afr Med J. 2024;47:112. doi: 10.11604/pamj.2024.47.112.33795
46. Keppens C, Van Royen Y, Brysse A, Cotteret S, Høgdall E, Kuhlmann TP, et al. Incidents in Molecular Pathology: Frequency and Causes During Routine Testing. Arch Pathol Lab Med. 2021;145(10):1270-1279. doi: 10.5858/arpa.2020-0152-OA.
47. Troiano G, Nante N, Fanelli A, Rossolini GM, Pecile P, Bordonaro P, et al. The experience of Careggi Hospital (Florence) regarding Not Received Samples (NRS): a pilot study of Risk Management in the Clinical Laboratory. J Prev Med Hyg. 2020;61(1):E6-E8. doi: 10.15167/2421-4248/jpmh2020.61.1.1218
48. Kadić D, Avdagić-Ismić A, Hasić S, Bošnjak F. Fasting state requirements for blood sampling: a survey of patients in Cantonal Hospital Zenica, Bosnia and Herzegovina. Med Glas (Zenica). 2021;18(2):352-356. doi: 10.17392/1347-21
49. Leonard SH, Chin-Yee I, Delport J, Crozier A, Abdulsatar F. Improving wound swab collection in paediatric patients: a quality improvement project. BMJ Open Qual. 2023;12(3):e002170. doi: 10.1136/bmjoq-2022-002170
50. Shinde SV, Dhanve MJ. Audit in surgical histopathology at a tertiary healthcare center: Study of preanalytical and analytical phase. Indian J Pathol Microbiol. 2021;64(1):136-139. doi: 10.4103/IJPM.IJPM_640_20
51. Reddy B, Cassim N, Treurnicht F, Makatini Z. Factors influencing the high rejection rates of HIV 1/2 serology samples at Charlotte Maxeke Johannesburg Academic Hospital and the cost implications. S Afr J HIV Med. 2022;23(1):1326. doi: 10.4102/sajhivmed.v23i1.1326
How to cite: Azocar González I, González-González ML, Sepúlveda Maturana F, Azocar González C, Ramírez-Pereira M. Pre-analytical Errors in Clinical Laboratories: An Integrative Review. Enfermería: Cuidados Humanizados. 2024;13(2):e4223. doi: 10.22235/ech.v13i2.4223
Authors’ contribution (CRediT Taxonomy): 1. Conceptualization; 2. Data curation; 3. Formal Analysis; 4. Funding acquisition; 5. Investigation; 6. Methodology; 7. Project administration; 8. Resources; 9. Software; 10. Supervision; 11. Validation; 12. Visualization; 13. Writing: original draft; 14. Writing: review & editing.
I. A. G. has contributed in 1, 2, 3, 5, 6, 7, 9, 10, 11, 12, 13, 14; M. L. G. G. in 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14; F. S. M. in 2, 3, 5, 6, 12, 13; C. A. G. in 2, 3, 5, 6, 12, 13; M. R. P. in 1, 3, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14.
Scientific editor in charge: Dr. Natalie Figueredo
Enfermería: Cuidados Humanizados, 13(2)
julio-diciembre 2024
DOI: 10.22235/ech.v13i2.4223